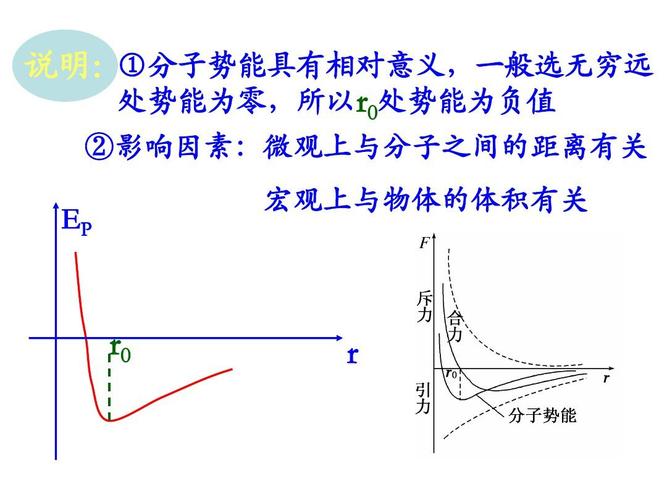
分子间平衡距离指分子间引力与斥力相等时的间距。当分子间距小于时表现为斥力,距离越小斥力越大。间距大于时表现为引力,距离增大时,引力先增大后减小,到无穷远时为零。
二、分子间作用力在哪分子间作用力只存在于分子(molecule)与分子之间或惰性气体(noble gas)原子(atom)间的作用力,又称范德华力(van der waals),具有加和性,属于次级键。
氢键(hydrogen bond)、弱范德华力、疏水作用力、芳环堆积作用、卤键都属于次级键(又称分子间弱相互作用)。
(图片来自网络侵删)
1、当r=ro(ro=10^-10米)时,分子间的引力和斥力相平衡,分子力为零,此位置叫做平衡位置。
2、当r<r0时,随r的减小,F引、F斥都增大,F斥比F引增大得快,F斥>F引,分子力表现为斥力,r减小,分子力增大。
3、当r>r0时,随r的增加,F引、F斥都减小,F斥比F引减小得快,F斥<F引,分子力表现为引力。