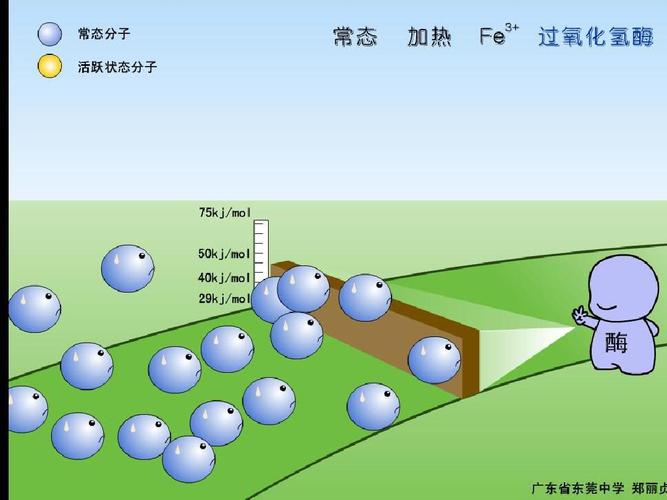
催化剂的作用:在化学反应中催化剂能降低反应所需的活化能,从而成百上千倍地提高反就速率。催化剂提高速率的原理是改变反应途径、降低或增加反应的活化能,增加了活化分子数量。并且在反应的过程中,质量和性质不发生变化。不过,催化剂不能催化所有化学反应,并且某些化学反应可以同时存在多种催化剂。
化学反应速率依赖三个因素:碰撞频率、能量因素、概率因素(有效碰撞)。有效碰撞:能发生化学反应的分子间碰撞。活化分子:能发生有效碰撞的分子。活化能:在任何化学反应中,反应物分子必须超过一定的能阈,成为活化的状态,才能发生变化,形成产物。
在化工生产、科学家实验和生命活动中,催化剂都大显身手。例如,硫酸生产中要用五氧化二钒作催化剂。由氮气跟氢气合成氨气,要用以铁为主的多分组催化剂,提高反应速率。
(图片来自网络侵删)
在炼油厂,选用不同的催化剂,就可以得到不同品质的汽油、煤油。汽车尾气中含有害的一氧化碳和一氧化氮,利用铂等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。