金属活动顺序表中,金属性减弱,即还原性减弱,但其金属对应离子的氧化性反向,即增强。也就是一般位置越后的金属,金属性越弱,原子的还原性越弱;位置越前的金属,金属性越强,原子的还原性越强。
金属活动顺序表:K、Ba、Ca、Na、Mg、Al、Mn、Zn、Cr、Fe、Co、Ni、Sn、(H)、Cu、Hg、Pb、Ag、Pt、Au。H左边的金属都可以与H+反应,释放出H2。H右边的金属都不能与H+反应——但不是不能和酸反应。
金属活动性规律:排在前面的金属可以将排在后面的金属从它们的金属溶液中置换出来。(若金属过于活泼,则会直接与水反应,并不会与水中的金属离子反应)。理论上讲,金属活动性表中铁及排在其前的金属均可置换出纯水中的氢。
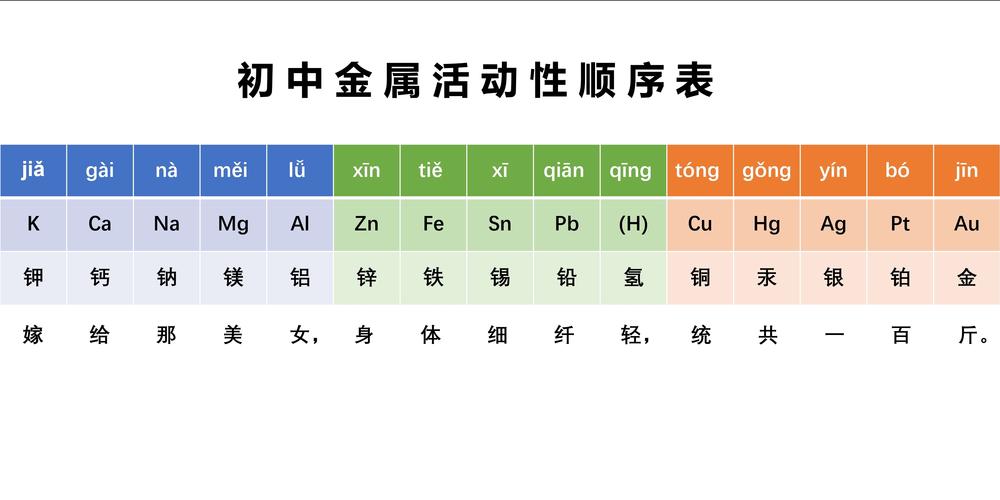
(图片来自网络侵删)
若只考虑氢离子的氧化性,排在氢(H)前的金属才能和非氧化性酸反应,置换出氢。排在越后的金属越容易,也越先从它们的化合物中被置换出来;排在越前的金属越容易,也越先把其他化合物中的金属置换出来。